君实生物:FDA已受理重新提交的特瑞普利单抗治疗鼻咽癌上市申请
石军生物的Trepril单克隆抗体突破FDA又有新进展。
日前,君实生物发布公告称,美国美国食品药品监督管理局已接受重新提交的特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者一线治疗和含铂治疗复发或转移性NPC后二线或以上治疗的单药的生物制品许可申请
FDA已将处方药用户支付法案的目标审查日期定为2022年12月23日。
2021年3月,君实生物宣布向FDA提交用于治疗复发性或转移性鼻咽癌的特雷普利单克隆抗体BLA,并获得滚动审评特雷普利单克隆抗体成为首个向FDA提交上市申请的国产抗PD—1单克隆抗体
与新型冠状病毒疫情有关的旅行限制使美国食品和药物管理局无法前来完成必要的现场检查此前,FDA表示,由于需要在中国进行现场检查,重新提交BLA的审查时限将为6个月
如果获得批准,君实生物的北美合作伙伴Coherus BioSciences计划于2023年第一季度在美国推出TereplizumabTereplizumab也将成为美国首个也是唯一一个用于鼻咽癌治疗的肿瘤免疫药物
君实生物首席医疗官Patricia Keegan表示:在接下来的几个月里,我们将与FDA密切合作,促进对这种创新疗法的审查。
根据消息显示,在批准Tereplizumab用于治疗鼻咽癌后,Coherus在美国的战略将包括通过联合开发协议,评估Tereplizumab与其他肿瘤药物和免疫疗法联合使用在主要适应症中产生显著临床效益的能力。
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。
责任编辑:苏小糖
最新阅读
-
百岁山与天津马拉松一起开跑,激发体育热爱
逐梦天津,奔赴健康之旅,2023天津马拉松已于10月15日正式开跑。此次大赛全程42.195公里,设马拉松、半程马拉松、健康跑三个项目,共吸引了来自29个国家和地区,近9万人报名。其中年龄最大的选手出...
2023-10-15 22:03 -
巨量引擎“抖「营」全收” 开启全渠道联合经营的新时
企业对于实现确定性增长与ROI提升的诉求愈加强烈,全渠道增长成为越来越多的企业的关注焦点。如何帮助企业建立全局视角,为全局ROI提升和生意增长创造增量?近日,在第十六届金投赏国际创意节的“全域增长”论...
2023-10-11 18:13 -
-
成绩单“耀眼”!中秋国庆武隆接待游客141.92万
今年国庆期间,武隆旅游人气超旺,各景区景点节日氛围浓厚,市民、游客出游热情高涨。据统计,今年中秋国庆期间武隆共接待游客141.92万人次,实现综合旅游收入45650.82万元,较2022年同期分别增长...
2023-10-08 18:20 -
家电市场迎“金九银十” 品质家电更受年轻消费者青睐
“金九银十”是家电消费旺季。在一系列促消费政策助推下,家电厂商抢抓机遇深挖潜力,中秋国庆假期家电市场销售明显升温。2023年是被商务部确定的“消费提振年”,有关部门出台政策措施促进电子产品消费、家居消...
2023-10-08 14:36 -
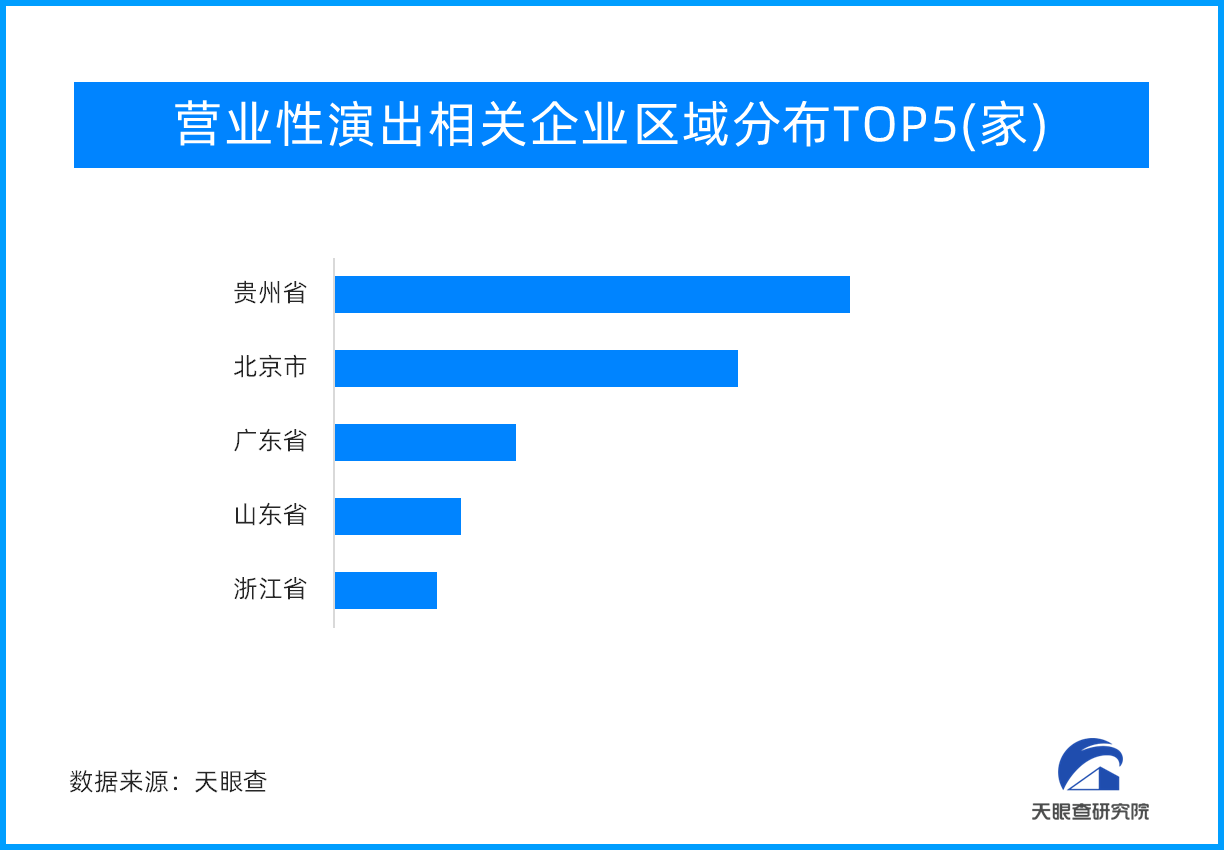
旅游市场带“火”演艺市场 营业性演出超20亿元,同
近日,据中国演出行业协会监测数据显示,全国营业性演出44237场,与去年十一假期同比增227.68%,与2019年同比增长48.95%;票房收入20.05亿元,与去年同比增长322.14%,与2019...
2023-10-08 14:19 -
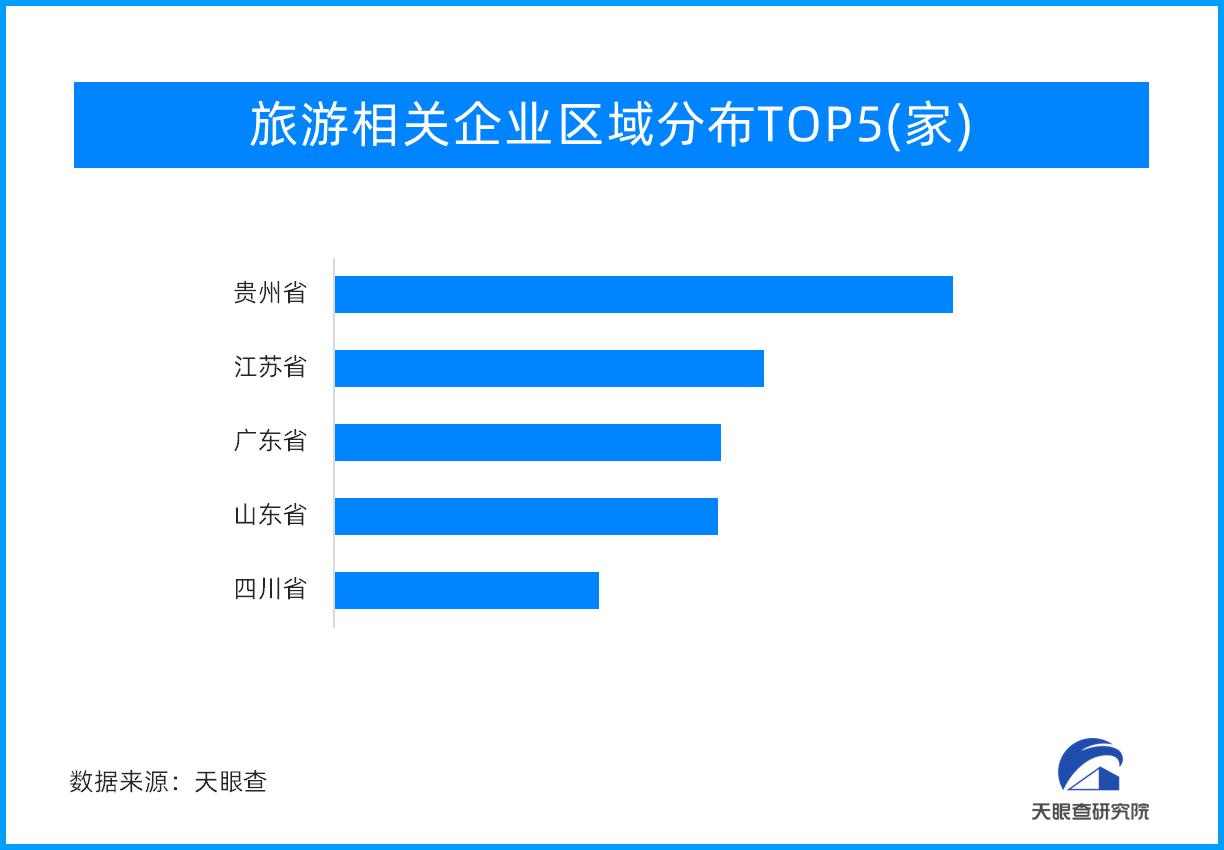
旅游收入同比增长129.5%!中秋国庆“超级黄金周
近日,文化和旅游部统计数据显示,2023年中秋节、国庆节假期,文化和旅游行业恢复势头强劲,全国假日市场平稳有序。经测算,国内旅游出游人数8.26亿人次,按可比口径同比增长71.3%,按可比口径较201...
2023-10-08 14:05 -
数智赋能行业变革,见证企业超凡蜕变——爱采购明星企
21世纪以来,科技领域迎来一轮轮颠覆性的变革——人工智能技术的次次迭代,信息化、智能化的汹涌浪潮,不断推动着中国制造企业持续向数智化阶段大步迈进,势不可挡。技术发展为各行各业持续积蓄着活力,有无数新兴...
2023-09-28 15:13 -
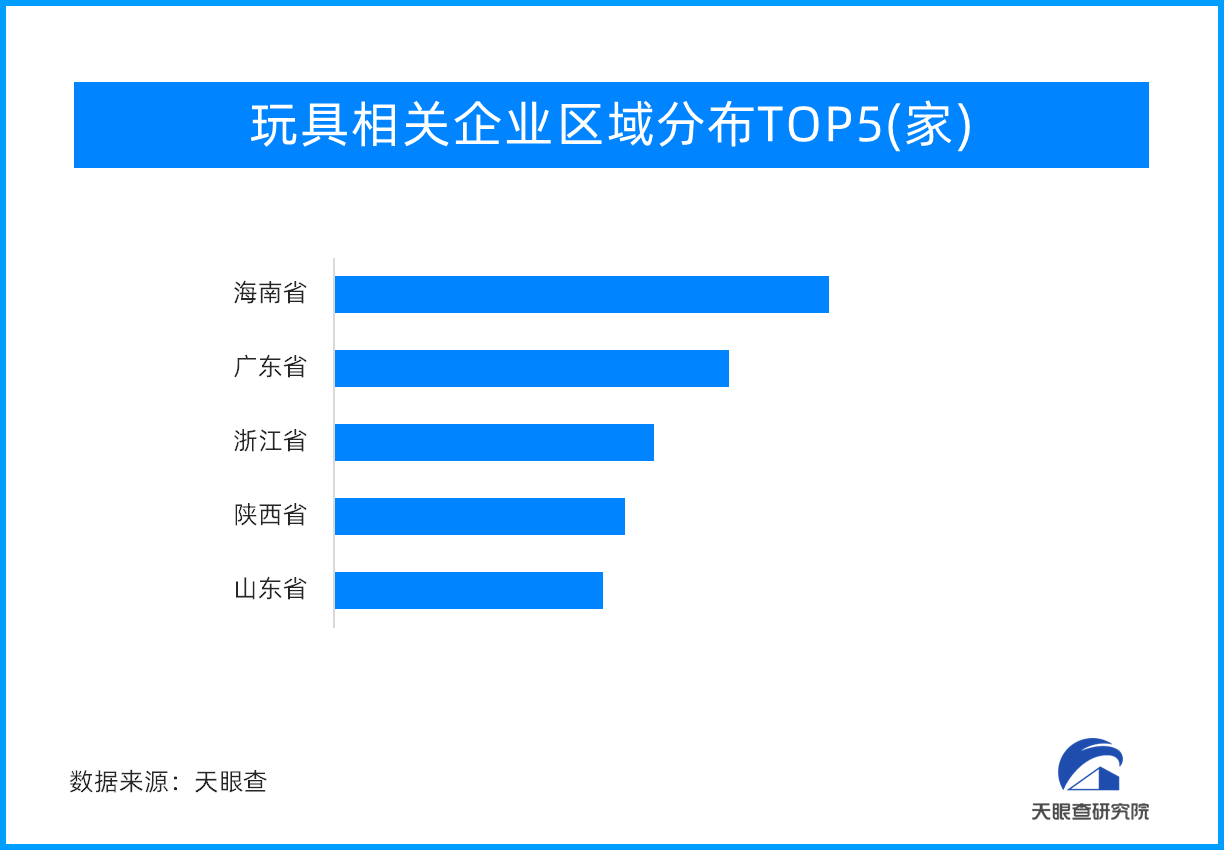
天眼新知 — 益智玩具、毛绒玩具、潮流玩具…玩具市
玩具给儿童构建了一个美好的世界,不仅给孩子们带来快乐,同时给成年人启发,在残酷的生活中,让他们想起有关勇气、好奇心和对世界温柔相待。一、玩具产业:成长道路不可或缺的“玩伴”玩具产业是指以玩具产品为经营...
2023-09-27 17:41 -
中国农资固始服务中心《农作物种植示范基地》举办首届
中国农民丰收节前夕,由中国农资固始服务中心举办的首届农作物种植示范基地现场观摩会,在河南省固始县洪埠乡倪岗村700亩示范田举行。据负责人杨跃柳介绍,此次举办的目的,是为贯彻中华全国供销总社第七届理事会...
2023-09-23 18:46